抗生素曾一度是致病菌的天敵。由于抗生素的濫用,細菌產(chǎn)生耐藥性的速度遠高于新抗生素研發(fā)的速度,導(dǎo)致了“超級耐藥菌”的出現(xiàn),堪稱細菌中的“小強”。
噬菌體是一種病毒,這種病毒專門“感染”并殺死細菌。在發(fā)現(xiàn)伊始,噬菌體就被用來對抗細菌感染。作為“殺菌利器”,噬菌體只要遇到宿主細菌就會鉆進其體內(nèi)并進行大量繁殖,從內(nèi)部裂解細菌,釋放出成百上千的下一代噬菌體,自此循環(huán)直到把所有的細菌斬盡殺絕。
此前,中國科學(xué)院深圳先進技術(shù)研究院馬迎飛團隊聯(lián)合醫(yī)院實現(xiàn)了深圳市首例應(yīng)用噬菌體治療耐藥鮑曼不動桿菌肺部感染的臨床試驗,展示了噬菌體治療臨床超級耐藥菌的感染方面具有極大的應(yīng)用價值。那么,將噬菌體應(yīng)用在臨床中會遇到哪些難題?

論文上線截圖
12月14日,馬迎飛團隊在國際學(xué)術(shù)期刊《核酸研究》上發(fā)表最新研究進展,提出了一種高通量制備底盤噬菌體的方法。該研究解決了在高通量刪除噬菌體冗余基因方面的三大難題,為噬菌體治療和噬菌體合成生物學(xué)的研究提供巨大助力。馬迎飛研究員為該文章的通訊作者,其博士生袁盛建為第一作者。深圳先進院為第一單位。
改善“殺菌利器”面臨三大挑戰(zhàn)
過去,我國在抗生素上的使用占全球使用量的一半,這使我國人民的身體健康受到超級細菌的威脅。如何對抗耐藥菌成為科學(xué)界面臨的巨大難題,而噬菌體合成生物研究為解決這一難題提供了新的思路和方法。
面對超級耐藥菌,噬菌體治療是最有效的殺手锏之一。2014年,噬菌體療法被美國國家過敏與傳染病研究所列為應(yīng)對抗生素抗藥性的重要武器之一。
我們能否對這樣的殺手锏進行改進,比如向噬菌體基因組內(nèi)插入能夠為其增加“殺傷力”的基因,讓噬菌體能夠更加勇往直前且大殺四方。
噬菌體通常具有較小的基因組,其中還有很多的“冗余基因”,導(dǎo)致基因組內(nèi)沒有空余的位置插入“基因武器”。同時,這些“冗余基因”有可能會編碼一些對人體有害的蛋白。對此,研究團隊設(shè)想,如果能將噬菌體基因組內(nèi)的“冗余基因”刪除,得到一個精簡的安全的“底盤噬菌體”,同時獲得足夠的位置插入功能基因。
如何實現(xiàn)這一目標(biāo),科研團隊面臨三大挑戰(zhàn):一是如何高通量快速地鑒定和刪除噬菌體的“冗余基因”;二是怎樣同時獲得具有更高殺菌效率的突變噬菌體;三是逐個刪除這些基因需要巨大的工作量。這些挑戰(zhàn)都使得研究團隊在獲取“底盤噬菌體”的路上異常艱難。
開發(fā)迭代噬菌體基因組簡化系統(tǒng)
那么,馬迎飛團隊是如何解決這三大難題的呢?
在細菌中,有一種對抗噬菌體的防御系統(tǒng)叫做CRISPR-CAS系統(tǒng),當(dāng)噬菌體侵染到含有這一系統(tǒng)的細菌時,噬菌體的基因組會被“切割”。對此,研究人員可以在細菌中通過人工合成的方式設(shè)計一套CRISPR-CAS系統(tǒng),當(dāng)噬菌體基因組進入含有這一系統(tǒng)的細菌內(nèi)部時,某個特定的基因將會被刪除。
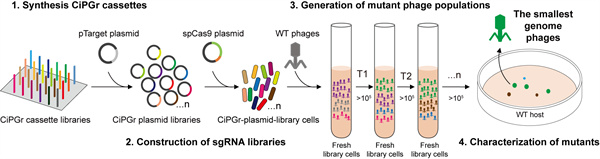
實驗流程設(shè)計 科研團隊供圖
正是基于CRISPR的原理,馬迎飛團隊開發(fā)了一種自上而下的全基因組簡化方法,稱為“基于CRISPR-Cas9的迭代噬菌體基因組簡化方法”(CRISPR/Cas9-based iterative phage genome reduction, CiPGr)。
團隊結(jié)合芯片合成技術(shù)針對測試的噬菌體的不同基因構(gòu)建了大量的CRISPR系統(tǒng),接下來將含有針對不同噬菌體基因的CRISPR-CAS系統(tǒng)宿主菌混合在一起,并被噬菌體侵染。噬菌體會隨機進入到一個細菌內(nèi),被其刪除一個基因。若被刪除的基因無足輕重,那么噬菌體會在細菌內(nèi)繼續(xù)繁殖,釋放出更多子代噬菌體,再進入下一個細菌并被隨機刪除下一個基因。這一過程自發(fā)進行,不斷有更多的冗余基因被刪除,最終獲得精簡的、有活性的底盤噬菌體。
在CiPGr過程中,研究團隊只需要獲得噬菌體基因組序列,就能夠?qū)⒃?/span>方法輕松推廣至其他野生型噬菌體。這些精簡的噬菌體能夠整合更多的基因元件以增強噬菌體的功能,在噬菌體治療中具有巨大的應(yīng)用潛力。
“該研究也提示,噬菌體基因組中必需、非必要和準(zhǔn)必需基因的鑒定對于噬菌體基因組的重新設(shè)計和噬菌體生物學(xué)的研究具有重大意義。”馬迎飛說。(趙梓杉)
編輯:李芊諾
責(zé)編:張永杰
審核:陳雪輝
請輸入驗證碼